Usability Dokumentation: alles nach Norm
Entwickeln Sie nutzeroptimiert- und zentriert
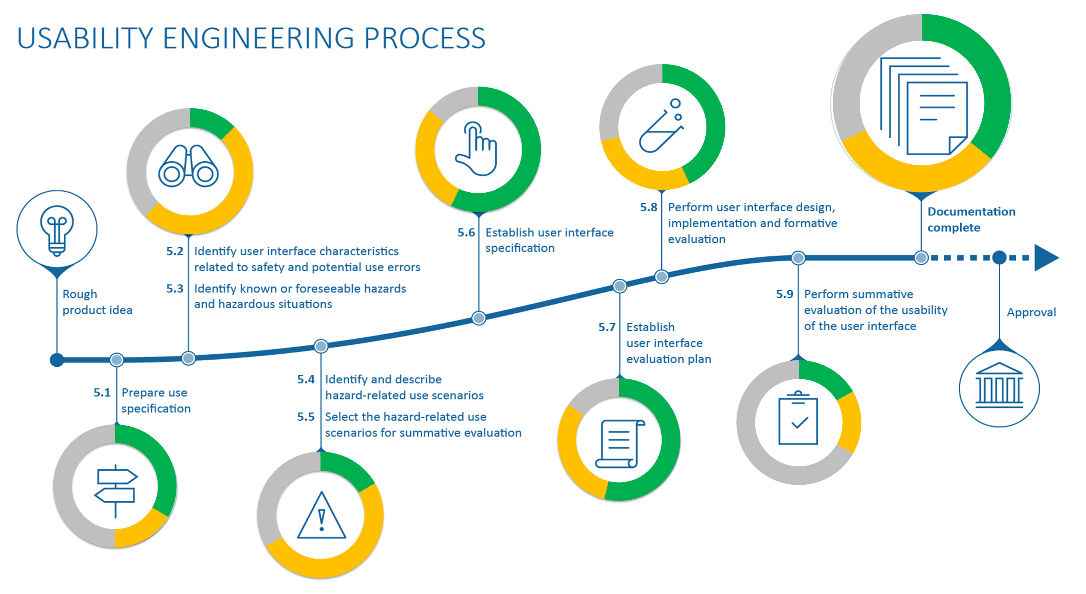
Use-Lab hat Erfahrung in der Erstellung und Bewertung von kompletten Usability Dokumentationen, wie z.B. der Use Scenarios, Use Specifications oder des kompletten Usability Engineering Files. Fragen Sie uns einfach – wir überprüfen Ihre bestehenden Dokumente, oder erstellen Ihre Dokumentation in enger Absprache mit Ihnen von Grund auf neu. Dabei berücksichtigen wir die relevanten Gesetze und Standards wie z.B. MDR, IEC 62366, ISO 14971 und ISO 13485.

Use-Lab ist ein zuverlässiger, flexibler und kreativer Partner für Gebrauchstauglichkeitsstudien im Rahmen der Entwicklung von Kombinationsprodukten und medizinischen Geräten.
Florian Schauderna
Senior Manager Usability/Human Factors Engineering
Überlassen Sie nichts dem Zufall
Durch die mehr als 20 jährige Erfahrung im Bereich der Zulassung von Medizinprodukten und der Dokumentation der zugehörigen Prozesse sowie durch die aktive Mitarbeit in zahlreichen nationalen und internationalen Normungsgremien und Arbeitskreisen, ist Use-Lab ein kompetenten Partner bei der Erstellung zulassungsrelevanter Dokumente.
Selbstverständlich besprechen wir mit jedem Kunden die individuellen Anforderungen und die internationalen Zielmärkte im Vorfeld. Alle entwicklungsbegleitenden Dokumente, wie die Spezifikationsdokumente oder Evaluierungspläne und -berichte werden von uns normenkonform erstellt, so dass diese direkt mit dem Usability Engineering File verlinkt werden können. Darüber hinaus übernehmen wir auch gerne die Erstellung des Usability Engineering Files oder des Human Factors Evaluation Reports für die FDA oder unterstützen Sie bei der Erstellung des Risikomanagement Files, der Designdokumentation oder der finalen Produktakte.
Durch die mehr als 20 jährige Erfahrung im Bereich der Zulassung von Medizinprodukten und der Dokumentation der zugehörigen Prozesse sowie durch die aktive Mitarbeit in zahlreichen nationalen und internationalen Normungsgremien und Arbeitskreisen, ist Use-Lab ein kompetenten Partner bei der Erstellung zulassungsrelevanter Dokumente.
Selbstverständlich besprechen wir mit jedem Kunden die individuellen Anforderungen und die internationalen Zielmärkte im Vorfeld. Alle entwicklungsbegleitenden Dokumente, wie die Spezifikationsdokumente oder Evaluierungspläne und -berichte werden von uns normenkonform erstellt, so dass diese direkt mit dem Usability Engineering File verlinkt werden können. Darüber hinaus übernehmen wir auch gerne die Erstellung des Usability Engineering Files oder des Human Factors Evaluation Reports für die FDA oder unterstützen Sie bei der Erstellung des Risikomanagement Files, der Designdokumentation oder der finalen Produktakte.



